Les graines de poisson sont le composant le plus important pour la pisciculture. Les ressources en eau douce de notre pays pour la pisciculture sont estimées à 2,85 millions d'hectares d'étangs et de réservoirs. De plus, 2,05 millions d'hectares supplémentaires de plan d'eau sont disponibles sous forme de réservoirs ou de lacs. Il a été estimé que près de 14 250 millions d'alevins seraient nécessaires pour ensemencer même les 2,85 millions d'hectares actuellement disponibles avec un taux d'empoissonnement prudent de 5 000 alevins/ha. La production actuelle est de 15007 millions d'alevins. En dehors de cette, au moins une quantité supplémentaire de 4100 millions d'alevins est nécessaire pour ensemencer la surface disponible des lacs et réservoirs avec un taux de chargement moyen de 2000 alevins/ha. Cela indique qu'il est nécessaire d'élever les alevins pour stocker les ressources en eau disponibles.
Les graines de poisson sont obtenues à partir de trois sources - riveraines, écloseries et bundhs. La collecte de graines de source riveraine était une pratique séculaire. Cette méthode est ardue et nous obtenons le mélange de graines de poisson désirées et indésirables. Les écloseries sont le meilleur moyen d'obtenir des graines de poisson. En dehors de ceux-ci, l'élevage de bundh est également une bonne méthode pour récolter les graines de poissons en créant un habitat naturel.
Les différents systèmes fluviaux de l'Inde présentent des variations en ce qui concerne la répartition et l'abondance de leur faune piscicole. Cela est principalement dû à leurs conditions écologiques individuelles, comme le dégradé, terrain, couler, profondeur, Température, substrats, etc. Les rivières du nord sont pérennes et soutiennent de riches pêches commerciales. A l'exception des régions deltaïques, la pêche des fleuves péninsulaires est pauvre tant dans les cours supérieurs que moyens.
1 je m du c e ré B r besoin je m g T e c h non je o g oui
Les carpes se reproduisent dans les eaux vives comme les rivières. Naturellement, ils ne se reproduisent jamais dans des eaux confinées. Les graines collectées à partir des ressources naturelles sont généralement un stock mixte avec des variétés à la fois désirables et indésirables. La séparation des graines désirables du stock mélangé est un gros problème. En raison de la manipulation, les variétés désirables peuvent mourir. Si des graines de poissons prédateurs sont trouvées, ils endommagent les graines de poisson désirables. Un autre gros problème est de ne jamais obtenir le numéro requis dans la collection naturelle. La disponibilité de semences pures est très difficile. Pour surmonter tous ces problèmes, l'élevage induit est une excellente technique pour obtenir des graines de poisson pures et nécessaires. Il a plusieurs avantages. Avec la reproduction induite, des semences pures d'espèces souhaitables peuvent être obtenues. Supposons que la graine de rohu soit nécessaire, seules les graines de rohu peuvent être produites en quelques jours. Le nombre requis de graines peut être produit avec cette technique. Supposons qu'une ferme piscicole ait besoin de 1 crore de graines de poisson, ce nombre peut être produit très facilement en moins de temps. Les problèmes d'identification et de ségrégation des semences ne se posent pas. Cette technique est très simple. Des graines saines peuvent être produites. Les poissons peuvent frayer plus d'une fois par an. L'hybridation est possible.
Dans les techniques d'élevage induit, quatre principaux types de matériaux sont utilisés pour faire des injections aux poissons - les extractions de la glande pituitaire, HCG, ovaprim et ovatide.
Indiana vous ce ré Elevage g esprit h Pi t uitar oui gland ré Extr une ctio m
La pisciculture par extraction de l'hypophyse est un moyen efficace et fiable d'obtenir des graines pures de poissons cultivables et est pratiquée aujourd'hui à une échelle assez étendue en Inde ainsi que dans de nombreux autres pays du monde. Elle consiste à injecter à des poissons femelles et mâles matures des extraits d'hypophyse prélevés sur d'autres poissons matures.
H istori c une je Arrière g tour:
Le concept actuel du rôle de l'hypophyse dans la reproduction des vertébrés proviendrait des expériences d'Aschheim et de Zondek en 1927, lorsqu'ils découvrirent que les implants hypophysaires accéléraient le développement sexuel des souris femelles. Trois ans plus tard, en 1930, Houssay d'Argentine a réalisé la première expérience de ce type sur un poisson. Il a injecté un petit poisson-chat vivipare, Cresterodon decammaculatus avec des extraits d'hypophyse préparés à partir d'un autre poisson, Prochilodus platensis provoquant la naissance prématurée de jeunes en développement. En 1934, une technique réussie a pu être élaborée par Von Ihring dans certains poissons d'étang brésiliens ont été amenés à frayer en leur injectant une suspension de glandes pituitaires fraîches prélevées sur d'autres espèces de poissons de moindre valeur. Les Brésiliens, Donc, ont été les premiers à utiliser avec succès la technique de la pisciculture par hypophysation. En 1937, Le scientifique russe Gerbiskii a réussi à induire un nombre important d'esturgeons, Acipenser stellatus.
L'Inde est le troisième pays au monde à intégrer la technique dans son programme piscicole. La première tentative d'hypophysation en Inde a été faite par Hamid Khan en 1937 lorsqu'il a tenté d'induire la ponte de Cirrhinus mrigala par l'injection d'hypophyse de mammifère. La prochaine tentative a été faite par Hussain en 1945 avec certaines hormones comme 80-120 RV Prolan et Antiuitrin-S dans les femelles Labeo rohita et Cirrhinus mrigala. En 1955, Hiralal Choudhuri a réussi à induire la ponte chez Esomus danricus par injection intrapéritonale d'extrait hypophysaire de Catla catla. Il a également réussi à élever Pseudotropius atherinoides. Ramaswamy et Sunderaraj ont réussi à reproduire Heteropneustes fossilis et Clarias batrachus en 1955 et 1956 respectivement. Le premier succès dans la reproduction induite de carpes indiennes majeures par hypophysation a été obtenu en 1957 par Hiralal Chaudhuri et Alikunhi au CIFRI, Coupure.
Fis h P je tut une r oui Gla m ré :
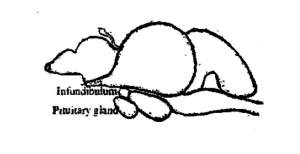
L'hypophyse du poisson est une petite corps mou et de couleur blanc crème. Il est plus ou moins rond chez les carpes. Il se trouve sur la face ventrale du cerveau (Fig. 3.1) derrière le chiasma optique dans une concavité du plancher de la boîte cérébrale, connue sous le nom de Sella turcica et entourée d'une fine membrane appelée dure-mère. Chez quelques poissons, il est attaché au cerveau par une tige mince, connu sous le nom de tige infundibulaire. Basé sur la tige infundibulaire, les glandes sont classées en deux types, à savoir, platybasic – sans tige, avoir un récessus infundibulaire ouvert et leptobasique - avec tige, ont un récessus infundibulaire oblitéré. Le type leptobasique des glandes pituitaires se trouve chez les carpes et le type platybasique chez les channidae et les nandidae. La taille et le poids de la glande varient en fonction de la taille et du poids du poisson. A Labeo rohita, le poids moyen de l'hypophyse est de 6,6 mg dans 1 à 2 kg de poisson, 10,3 mg dans 2-3 kg de poisson, 15,2 mg dans 3-4 kg de poisson et 18,6 mg dans 4-5 kg de poisson.
L'hypophyse sécrète les hormones gonadotropes, FSH ou Hormone Stimulante Folliculaire, et LH ou hormone lutéinisante. Les deux hormones sont sécrétées tout au long de l'année, mais la proportion dans laquelle elles sont sécrétées est directement corrélée au cycle de maturité gonadique. La FSH provoque la croissance et la maturation des follicules ovariens chez les femelles et la spermatogenèse dans les testicules des mâles. La LH aide à transformer les follicules ovariens en corps jaune chez les femmes et à favoriser la production de testostérone chez les hommes. Ces hormones ne sont pas spécifiques à une espèce, c'est à dire., une hormone obtenue à partir d'une espèce est capable de stimuler les gonades d'un autre poisson. Cependant, il existe une grande variabilité dans son efficacité selon les espèces. Des expériences menées sur l'élevage induit de poissons ont clairement montré l'efficacité relative des extraits d'hypophyse de poisson par rapport aux hormones hypophysaires de mammifères, hormones sexuelles et divers stéroïdes. C'est la raison pour laquelle l'hypophyse du poisson est largement utilisée aujourd'hui dans les travaux d'élevage de poissons dans le monde entier.
Collecti o m o F Pituitar oui Glande :
Le poisson qui donne l'hypophyse, c'est-à-dire le poisson à partir duquel la glande pituitaire est prélevée est appelé le poisson donneur. Le succès de la reproduction induite des poissons dépend dans une large mesure de la sélection appropriée du poisson donneur. La glande doit de préférence être prélevée sur des poissons gravides pleinement mûrs, car la glande est la plus puissante au moment de la reproduction ou juste avant le frai. La puissance de la glande diminue après la ponte. Les glandes prélevées sur des poissons immatures ou épuisés ne donnent généralement pas de résultats satisfaisants. Les glandes des poissons induits prélevés immédiatement après la ponte se sont également avérées efficaces et peuvent être utilisées pour la reproduction d'autres poissons. Le moment le plus approprié en Inde pour la collecte des glandes pituitaires des principales carpes est de mai à juillet, car la majorité des carpes atteignent des stades avancés de leur maturité au cours de cette période. Depuis la carpe commune, Cyprinus carpio est un reproducteur vivace, ses individus matures peuvent être obtenus presque toute l'année pour la collecte de glandes. Les glandes sont généralement préférées pour être prélevées sur des poissons fraîchement tués, mais celles prélevées sur des spécimens conservés dans la glace sont également utilisées.
Plusieurs techniques sont adoptées pour la collecte des glandes pituitaires dans différents pays. En Inde, la technique couramment adoptée pour collecter les glandes consiste à couper le cuir chevelu du crâne de poisson par un coup oblique de couteau de boucher. Une fois le cuir chevelu retiré, la matière grise et les corps gras recouvrant le cerveau sont délicatement nettoyés avec un morceau de coton. Le cerveau ainsi exposé est soigneusement soulevé en le détachant des nerfs. Chez la majorité des cyprinidés, quand le cerveau est soulevé, la glande est laissée sur le sol de la boîte cérébrale. La dure-mère recouvrant la glande est ensuite retirée avec précaution à l'aide d'une aiguille fine et d'une pince. La glande exposée est ensuite ramassée intacte sans lui causer de dommages, car les glandes endommagées et cassées entraînent une perte de puissance.
Les glandes sont également collectées par le foramen magnum. Il est, En réalité, une méthode beaucoup plus facile d'élimination des glandes qui est couramment pratiquée par les professionnels pour la collecte à grande échelle dans les marchés aux poissons bondés et bruyants. Dans cette méthode de prélèvement des glandes, le poisson doit être essentiellement décapité. Sur les marchés, les glandes sont prélevées sur des têtes de poisson déjà coupées par les détaillants. Dans les têtes de poisson coupées, le foramen est clairement visible de l'arrière contenant de la matière grise et des corps gras. Le cerveau se trouve sur les faces ventrales du foramen. Pour retirer la glande, la matière grise et les corps gras sont d'abord éliminés en insérant l'extrémité émoussée de la pince dans le foramen et en retirant toute la matière sans perturber le cerveau. Le cerveau est soulevé avec précaution et poussé vers l'avant ou est tiré hors du trou. La glande située au fond de la boîte cérébrale est ensuite ramassée à l'aide d'une paire de pincettes fines. Un expérimentateur parvient facilement à prélever environ 50 à 60 glandes en une heure en adoptant cette technique de prélèvement.
P réservation o F Pituit une r oui Glande s :
Si les glandes collectées ne sont pas destinées à être utilisées ici et là, ils doivent être conservés. En raison de leur nature glyco- ou muco-protéique, ils sont susceptibles d'action enzymatique immédiate. Les glandes pituitaires peuvent être conservées par trois méthodes - l'alcool absolu, l'acétone et la congélation. La conservation de l'hypophyse du poisson dans l'alcool absolu est préférée en Inde. De plus, les expériences faites jusqu'à présent avec des glandes conservées à l'alcool sur des carpes indiennes majeures ont donné des résultats plus positifs qu'avec des glandes conservées à l'acétone.
Les glandes après prélèvement sont immédiatement mises dans de l'alcool absolu pour dégraissage et déshydratation. Chaque glande est conservée dans une fiole distincte marquée en série pour faciliter l'identification. Après 24 heures, les glandes sont lavées avec de l'alcool absolu et conservées à nouveau dans de l'alcool absolu frais contenu dans des flacons de couleur foncée et conservés soit à température ambiante, soit au réfrigérateur. Le changement occasionnel d'alcool aide à maintenir les glandes en bon état pendant de plus longues périodes. Afin d'empêcher l'humidité de pénétrer à l'intérieur des ampoules, ils peuvent être conservés dans un dessiccateur contenant du chlorure de calcium anhydre. Il est préférable de conserver les glandes au réfrigérateur. Ils peuvent être conservés au réfrigérateur jusqu'à 2-3 ans et à température ambiante jusqu'à un an.
L'acétone est également un bon conservateur. Dans cette méthode, peu de temps après la collecte, les glandes sont conservées dans de l'acétone fraîche ou dans de l'acétone refroidie par de la glace sèche à l'intérieur d'un réfrigérateur à 100 °C pendant 36-48 heures. Au cours de cette période, l'acétone est changée 2 à 3 fois à des intervalles d'environ 8 à 12 heures pour un dégraissage et une déshydratation appropriés. Les glandes sont ensuite retirées de l'acétone, mettre sur un papier filtre et laisser sécher à température ambiante pendant une heure. Ils sont ensuite conservés au réfrigérateur à 100 C, de préférence dans un dessiccateur chargé de chlorure de calcium ou de tout autre agent desséchant. La conservation des glandes dans l'acétone est largement pratiquée en URSS et aux USA.
P réparation o F Pituita r oui Gl une m ré E extraire :
Les glandes conservées sont ensuite pesées. Ceci est essentiel pour une détermination précise de la dose à administrer en fonction du poids des reproducteurs. Le poids de la glande peut être pris individuellement ou en groupe. Pour obtenir un poids plus précis, une glande doit être pesée exactement deux minutes après son retrait de l'alcool.
L'extrait hypophysaire doit être préparé juste avant l'injection. La quantité de glande nécessaire à l'injection est d'abord calculée à partir du poids du reproducteur à injecter. Les glandes sont ensuite sélectionnées et la quantité requise de glandes est extraite des ampoules. On laisse l'alcool s'évaporer, si les glandes sont conservées dans l'alcool. Les glandes séchées à l'acétone sont directement prélevées des ampoules pour macération.
Les glandes sont ensuite macérées dans un homogénéisateur de tissus en ajoutant une quantité mesurée d'eau distillée ou de solution de sel ordinaire ou de toute solution physiologique isotonique avec le sang du poisson receveur. Les résultats les plus réussis de l'élevage induit chez les principales carpes indiennes ont jusqu'à présent été obtenus avec de l'eau distillée et une solution de sel commun à 0,3 %. La concentration de l'extrait est généralement maintenue dans la plage de 1 à 4 mg de glande pour 0,1 ml de milieu, c'est-à-dire au taux de 20-30 g. de la glande dans 1,0 ml de milieu. Après homogénéisation, la suspension est transférée dans un tube à centrifuger. Lors du transfert, l'homogénat doit être bien agité afin que les particules glandulaires déposées et mélangées à la solution pénètrent dans le tube de centrifugation. L'extrait dans le tube est centrifugé et le liquide surnageant est aspiré dans une seringue hypodermique pour injection.
L'extrait hypophysaire peut également être préparé en vrac et conservé dans de la glycérine (1 partie d'extrait :2 parties de glycérine) avant la saison de reproduction des poissons afin d'éviter la difficulté de préparer l'extrait à chaque fois avant l'injection. L'extrait de bouillon doit toujours être conservé au réfrigérateur ou dans de la glace.
T e c h niq vous e o F B ree ré ment :
L'opération de reproduction induite des carpes majeures est reprise lorsque la mousson régulière s'installe, les poissons deviennent complètement mûrs et la température de l'eau baisse. Les femelles ayant un tour, un abdomen mou et bombé avec un évent rougeâtre gonflé et des mâles avec de la laitance suintant librement sont sélectionnés pour la reproduction. Un mâle reproducteur peut également être facilement distingué par la rugosité de la surface dorsale de ses nageoires pectorales.
1 . Faire s ag e o F pitui t ar oui extra une c t :
L'aspect le plus important de la reproduction induite des poissons est l'évaluation des dosages appropriés d'extrait hypophysaire. La puissance de la glande varie selon la taille et les stades de développement sexuel du donneur, ainsi que les espèces du poisson donneur, moment de la collecte des glandes et de leur bonne conservation. La dose de l'hypophyse est calculée en fonction du poids des reproducteurs à injecter. Il a également été remarqué que des doses identiques à des reproducteurs de poids similaires peuvent donner des résultats contradictoires en raison de la différence de maturité des gonades. Même de fortes doses d'hormones peuvent ne pas être efficaces si les gonades sont en phase de résorption. Par une sélection rigoureuse des reproducteurs et l'administration d'un poids connu d'extrait de glande pituitaire par kg de poids corporel des reproducteurs, une reproduction réussie peut être obtenue.
Des expériences sur la standardisation des doses indiquent que l'administration d'une faible dose préliminaire chez la reproductrice suivie d'une dose efficace plus élevée après 6 heures s'avère plus efficace qu'une seule dose knock-out. Une seule dose élevée s'est avérée utile lorsque les reproducteurs sont dans des conditions idéales et que le temps est favorable. Rohu répond bien à deux injections tandis que catla et mrigal à une et deux injections.
Une dose initiale à raison de 2-3 mg. de glande pituitaire par kg de poids corporel de poisson est administré uniquement à la reproductrice. Les reproducteurs mâles ne nécessitent aucune dose initiale, s'ils suintent de la laitance en exerçant une légère pression sur leur abdomen. Deux mâles contre chaque femelle forment un ensemble reproducteur. Pour faire un bon ensemble assorti, le poids des mâles ensemble doit être égal ou supérieur à celui de la femelle. Dans le cas où l'état de l'un des deux mâles n'est pas trouvé au stade de suintement libre, une injection initiale peut être administrée au mâle à raison de 2 à 3 mg/kg de poids corporel. Après 6 heures, une seconde dose de 5 à 8 mg/kg de poids corporel est administrée à la femelle, tandis que les deux mâles reçoivent la première ou la deuxième dose à raison de 2-3 mg/kg de poids corporel. De légères modifications des doses peuvent être apportées en fonction de l'état de maturité des reproducteurs et des facteurs environnementaux dominants. En l'absence d'équilibre chimique, 1-3 glandes pituitaires sont efficaces pour une paire de poissons.
2 . M e mais ré o F injection :
Les injections intra-crâniennes sont préférées en URSS et intra-péritonéales aux USA et au Japon. L'injection intramusculaire est la pratique la plus courante en Inde. L'injection intramusculaire est moins risquée par rapport aux autres méthodes. Les injections intra-péritoniales sont généralement administrées à travers les régions molles du corps, généralement à la base de la nageoire pelvienne ou parfois à la base de la nageoire pectorale. Mais il y a un certain risque d'endommager les organes internes, en particulier les gonades distendues lors de l'administration d'une injection intra-péritoniale chez des poissons pleinement matures.
Les injections sont généralement administrées au niveau du pédoncule caudal ou des régions de l'épaule près de la base de la nageoire dorsale. En faisant des injections aux carpes, l'aiguille est insérée sous une écaille en la maintenant parallèle au corps du poisson dans un premier temps, puis percée dans le muscle sous un angle. Il n'y a pas de règle absolue concernant le moment de l'injection. Les injections peuvent être faites à tout moment du jour et de la nuit. Mais comme la basse température est utile et que la nuit reste relativement plus calme, les injections sont généralement administrées en fin d'après-midi ou en soirée avec des horaires
La graine Production T technologies 33
tellement ajusté que le poisson est capable d'utiliser la quiétude de la nuit pour frayer sans être dérangé.
La seringue hypodermique la plus pratique utilisée à cette fin est une seringue de 2 cc ayant des graduations de division de 0,1 cc. La taille de l'aiguille de la seringue dépend de la taille des reproducteurs à injecter. L'aiguille n° 22 est commodément utilisée pour les carpes de 1 à 3 kg, Le n° 19 pour les plus grosses carpes et le n° 24 peuvent être utilisés pour les plus petites carpes.
L'utilisation d'anesthésiques lors de l'injection augmenterait considérablement la survie des géniteurs. Les anesthésiques couramment utilisés sont le MS 222 et la quinaldine. MS 222 peut être ajouté à l'eau à des doses de 50 à 100 mg/litre. Un rouleau de coton imbibé d'un 0,04 M de cette solution peut être inséré dans la bouche du poisson. La quinaldine est utilisée à raison de 50-100 mg/litre.
3 . B reedin g h ap une un ré spa w ning :
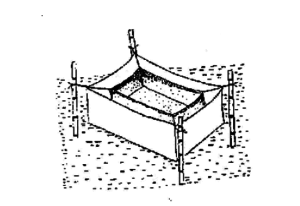
Après l'injection, les reproducteurs sont relâchés immédiatement à l'intérieur du hapa d'élevage. Un hapa d'élevage est généralement constitué d'un tissu fin mesurant 3,5 x 1,5 x 1,0 m pour les grands éleveurs et 2,5 x 1,2 x 1,0 m pour les éleveurs pesant moins de 3 kg. Tous les côtés du hapa d'élevage sont cousus et fermés à l'exception d'une partie en haut pour introduire les éleveurs à l'intérieur. Généralement, un ensemble d'éleveurs est libéré à l'intérieur de chaque hapa d'élevage, mais parfois, afin d'économiser sur le matériel hypophysaire, l'élevage communautaire est également tenté en réduisant le nombre de reproducteurs mâles. Après le lâcher du poisson, l'ouverture du hapa est bien fermée afin que les éleveurs ne puissent pas sauter et s'échapper. Au lieu de hapas, des citernes en ciment ou des piscines en plastique aussi grandes que des hapas peuvent également être utilisées pour l'élevage.
Le frai se produit normalement dans les 3 à 6 heures suivant la deuxième injection. Peu de temps après la fécondation, les œufs gonflent considérablement en raison de l'absorption d'eau. Les œufs fécondés des carpes majeures apparaissent comme des perles de verre brillantes d'une transparence cristalline tandis que les œufs non fécondés semblent opaques et blanchâtres. La taille des œufs d'une même espèce de différents reproducteurs varie considérablement. Les œufs entièrement gonflés des grandes carpes indiennes mesurent 2,5 mm de diamètre, le plus grand étant celui de catla et le plus petit de rohu. Les œufs de carpe sont de type non flottant et non adhésif. Le jaune ne possède pas de globule d'huile. Les grandes carpes indiennes ont une capacité de ponte abondante. leur fécondité, en moyenne, vaut 3,1 lakh en rohu, 1-3 lakh en catla et 1,5 lakh en mrigal.
Les œufs en développement sont conservés dans le hapa de reproduction sans être dérangés pendant une période d'au moins 4 à 5 heures après la ponte pour permettre aux œufs de durcir correctement à l'eau. Après ça, les œufs sont récupérés du hapa à l'aide d'une tasse et transférés dans un seau avec une petite quantité d'eau. Les reproducteurs sont ensuite sortis et pesés pour déterminer la différence avant et après la ponte. Cela donne une idée de la quantité d'œufs pondus. Le volume total et le nombre d'œufs peuvent être facilement calculés à partir du volume connu et du nombre d'œufs de la tasse d'échantillon. Le pourcentage d'œufs fécondés est également évalué en conséquence en procédant à un échantillonnage aléatoire avant et après la ponte. Cela donne une idée de la quantité d'œufs pondus. Le volume total et le nombre d'œufs peuvent être facilement calculés à partir du volume connu et du nombre d'œufs de la tasse d'échantillon. Le pourcentage d'œufs fécondés est également évalué en conséquence en procédant à un échantillonnage aléatoire.
4 . S tri p épingler g :
Cependant, les carpes chinoises ne se reproduisent pas naturellement et lorsqu'elles se reproduisent, le pourcentage de fertilisation est généralement très faible. Le stripping (Fig. 3.1) ou l'insémination artificielle sont donc suivis. Le poisson femelle est tenu avec sa tête inclinée vers le haut et la queue vers le bas et le ventre face au navire, et les œufs sont recueillis dans une auge en émail ou en plastique en appuyant sur le corps de la femelle. Le poisson mâle est ensuite tenu de la même manière et la laitance est expulsée dans le même creux. Les gamètes sont ensuite mélangées dès que possible à l'aide d'une plume d'oie pour permettre la fécondation. Les œufs fécondés sont ensuite lavés plusieurs fois avec de l'eau propre pour éliminer l'excès de laitance et laissés au repos dans l'eau douce pendant environ 30 minutes. Les œufs sont alors prêts à être relâchés dans les bassins d'éclosion.

T e chn je qu e o F h une tch je m g t h e e gg :
Les œufs collectés dans les hapas de reproduction sont transférés dans les hapas d'éclosion. Un hapa à éclore se compose de deux morceaux séparés de hapas, le hapa extérieur et le hapa intérieur. Le hapa intérieur est de plus petite taille et est monté à l'intérieur du hapa extérieur. Le hapa extérieur est constitué d'un tissu fin aux dimensions standard de 2 x 1 x 1 m tandis que le hapa intérieur est constitué d'un tissu en moustiquaire à mailles rondes aux dimensions de 1,75 x 0,75 x 0,5 m. Tous les coins des hapas extérieurs et intérieurs sont pourvus de boucles et de cordes pour faciliter l'installation. Environ 75, 000 à 1, 00, 000 œufs sont uniformément répartis à l'intérieur de chaque hapa interne. Les œufs éclosent en 14 à 20 heures à une température comprise entre 24 et 310 C. La période d'incubation, En réalité, est inversement proportionnel à la température. Après l'éclosion, les nouveau-nés s'échappent dans le hapa extérieur à travers les mailles du hapa intérieur. Le hapa intérieur contenant les coquilles d'œufs et les œufs morts qui sont retirés lorsque l'éclosion est terminée. Les nouveau-nés restent dans l'hapa externe sans être dérangés jusqu'au troisième jour après l'éclosion. Au cours de cette période, ils subsistent de la nourriture stockée dans leur sac vitellin. Au troisième jour, la bouche est formée et les nouveau-nés commencent à se déplacer et à se nourrir. A ce stade, ils sont soigneusement collectés dans le hapa extérieur d'éclosion et stockés dans des pépinières préparées.
Il a été découvert que les grandes carpes indiennes pouvaient être amenées à frayer deux fois au cours de la même saison avec un intervalle de deux mois. Les reproducteurs après la première ponte sont nourris avec des tourteaux d'arachide et du son de riz dans le rapport 1:1 à 2,5 pour cent du poids corporel. Lorsque des conditions climatiques favorables se présentent, ils mûrissent et sont prêts pour le frai.
Dans ré uce ré Frère e edin g w je t h H.C. g .
Aujourd'hui, l'extraction de la glande pituitaire est une technique bien établie pour la reproduction induite dans le monde entier. Son utilisation à grande échelle pose les problèmes suivants en ce qui concerne la disponibilité et la qualité de la glande pituitaire (G.P.). Approvisionnement insuffisant en P.G., coût élevé, variabilité de la puissance des gonadotrophines hypophysaires et tricherie par P.G. sans scrupules. Fournisseurs. Pour surmonter ces problèmes, La gonadotrophine chorionique humaine (H.C.G) a été trouvée comme alternative à l'hypophyse. H.C.G. a été découvert au début de 1927 par Aschheim et Zondek. Ils ont extrait une hormone de bonne qualité avec une activité gonadotrophique lutéinisante de l'urine de femmes enceintes. Les travailleurs russes ont utilisé pour la première fois la gonadotrophine chorionique en 1964 sous le nom commercial de Choriogohin et ont obtenu de bons résultats sur Loach. Bratanor (1963) et Gerbilski (1965) ont utilisé H.C.G sur des carpes et des truites et ont obtenu un grand succès. Tang (1968) a déclaré que lorsque les carpes chinoises étaient traitées avec de l'hypophyse de poisson en combinaison avec du C.G., l'efficacité sur la reproduction induite a augmenté. Une lecture de la littérature indique que H.C.G. est efficace seul ou en combinaison avec P.G. extrait en induisant divers poissons partout dans le monde.
H.C.G. est une glyco-protéine ou sialo-protéine, à cause des molécules de glucides attachées aux molécules de protéines. Sa fonction principale est de maintenir la production d'œstrogènes et de progestérone par le corps jaune. Il est produit par le placenta et excrété par l'urine pendant les premiers stades de la grossesse (2-4 mois). H.C.G comprend 2 sous-unités a et b et a une taille moléculaire de 45, 000-50, 000 daltons. Il contient 17 acides aminés, dont alanine, proline, sérine, la cystine et l'histidine sont importantes. En raison du grand nombre d'acides aminés, H.C.G. a une teneur élevée en protéines. Le poids moléculaire a été rapporté comme 59, 000 par filtration sur gel et 47, 000 par équilibre de sédimentation.
Pendant les premiers stades de la grossesse H.C.G. est riche dans l'urine des femmes enceintes. Plusieurs méthodes sont employées pour l'extraction de H.C.G. Aschheim et Zondek (1927) ont utilisé de l'éthanol pour la précipitation. Katzman et Caina ont utilisé des absorbants différents. L'extraction H.C.G brute commerciale est réalisée par filtration sur gel.
L'hormone folliculostimulante (FSH) et l'hormone lutéinisante (LH) de l'hypophyse jouent un rôle important dans la reproduction normale des poissons, c'est-à-dire en favorisant le développement des gonades, croissance, maturité et la ponte. H.C.G est plus ou moins similaire dans son caractère et sa fonction à F.S.H et L.H. Comme l'hypophyse est utilisée pour la reproduction induite des poissons, H.C.G peut également être utilisé pour la maturation précoce des gonades. La supériorité de H.C.G sur P.G peut être mesurée sur les bases suivantes. Le poisson atteint sa maturité plus rapidement avec H.C.G., le frai de la saison de reproduction peut être augmenté avec H.C.G., H.C.G. assure une meilleure survie du frai, il réduit l'intervalle de temps entre les doses préparatoires et finales, H.C.G est plus économique et a une longue durée de conservation, H.C.G est facilement disponible à partir d'une source standard, est donc plus fiable, des injections périodiques de H.C.G tout au long de l'année assurent une meilleure santé et une augmentation du poids et du développement gonadique La puissance de H.C.G est connue (30 UI/mg), disponible en paquets soignés de poids connus, aucune conservation n'est impliquée, ne peut pas être faux, Les poissons traités au H.C.G peuvent être utilisés plus d'une fois pour la reproduction induite au cours de la même saison, le taux de mortalité des nouveau-nés est négligeable, la consommation du médicament est moindre lors des élevages induits, H.C.G peut être utilisé comme hormone de croissance et l'absorption des œufs à la fin de la saison de reproduction est comparativement moindre par l'administration de H.C.G.
Le H.C.G brut est sous forme de poudre et de couleur blanc grisâtre ou jaune clair. Il se dissout facilement dans l'eau. La quantité calculée de H.C.G brut est prise dans un homogénéisateur de tissus et agitée pendant 5 à 10 minutes avec de l'eau distillée mesurée. Il est centrifugé pendant 3 à 5 minutes. Le liquide surnageant clair jaunâtre contenant les hormones H.C.G est prélevé et injecté immédiatement. Tout retard d'utilisation entraînera la perte de la puissance.
En cas de carpe argentée (Hypophthalmichthyes molitrix), l'utilisation de H.C.G s'avère assez efficace. La posologie est de 4 à 6 mg/kg. poids corporel du mâle, et 6-8 mg/kg de poids corporel de la première dose et après environ 6-7 heures, 10-12 mg/kg de poids corporel de la deuxième dose pour la femelle qui a donné de bons résultats. L'utilisation de H.C.G uniquement dans l'élevage des grandes carpes indiennes n'a pas donné de résultats positifs jusqu'à présent. Une combinaison de 60 à 80 % de H.C.G et de 40 à 20 % de P.G pour les carpes et les herbiers indiens (Ctenopharyngodon idella) est un succès. Les poissons qui sont amenés à se reproduire avec H.C.G seul sont des rougets, Cyprinus carpio, Lctalurus punctatus, Oreochromis nilotica, Aristichthys nobilis, Misgurnus fossilis, Esox lucius et Epinephelus tauvina.
Des travaux récents montrent que la combinaison de H.C.G et P.G. est plus recommandable que H.C.G ou P.G seul. Plus de travail doit être fait pour standardiser le dosage de H.C.G pour la reproduction induite des carpes majeures et des carpes chinoises.
Dans ré uce ré Bree ré dans g w ce h ô vapr je m
En raison du problème de la puissance variable des hypophyses, des alternatives ont été essayées. Des tentatives ont été faites dans divers pays pour utiliser les analogues des hormones lutéinisantes – les hormones de libération (LH-RH) pour la reproduction induite de poissons avec des degrés de succès variables. Cependant, le succès obtenu avec la LH-RH n'a pas toujours été constant, en dehors de sa dose plus élevée requise pour l'induction de la ponte. Cette enquête historique a ouvert la voie au développement d'une technologie simple et efficace pour la reproduction induite de la plupart des poissons cultivables. Dans un projet collaboratif, financé par le Centre de recherches pour le développement international, Canada au Dr Lin de Chine et au Dr Peter du Canada, une série d'enquêtes ont été menées pour développer une technologie fiable pour l'élevage des poissons. Leurs investigations ont conduit au développement d'une nouvelle technique appelée méthode « LNPE », dans lequel un analogue de LH-RH est combiné avec un antagoniste de la dopamine. Basé sur le principe, M/s Syndel Laboratories Limited, Le Canada a fabriqué un nouveau médicament appelé ovaprim.
Ovaprim est un produit prêt à l'emploi et la solution est stable à température ambiante. Il contient un analogue de 20 µg d'hormone de libération des gonadotrophines de saumon (sGnPHa) et un antagoniste de la dopamine, dompéridone à 10 mg/ml. La puissance de l'ovaprim est uniforme et contient du sGnRHa qui est connu pour être 17 fois plus puissant que la LH-RH (Peter, 1987). L'antagoniste de la dopamine, la dompéridone utilisée dans ovaprim serait également meilleure qu'un autre antagoniste couramment utilisé, pimozide. Ovaprim étant un produit prêt à l'emploi et ne nécessitant pas de stockage réfrigéré, semble être l'agent d'ovulation le plus pratique et le plus efficace.
Ce médicament est administré simultanément aux géniteurs femelles et mâles en une seule dose, contrairement à l'extrait hypophysaire qui est administré en deux doses fractionnées. Cela réduit non seulement la manipulation des géniteurs, mais permet également d'économiser un temps et une main-d'œuvre considérables, ce qui augmentera le coût de production des graines. La réponse au frai chez les espèces traitées s'avère supérieure à celle des espèces injectées d'extrait hypophysaire.
L'efficacité d'ovaprim pour l'élevage induit de carpes a donné des résultats très encourageants en catla, rohu, mrigal, Carpe d'argent, carpe herbivore, grosse tête, etc. La dose efficace requise pour diverses espèces de carpes varie considérablement. The common dose for all carps is 0.10-0.20 ml ovaprim/kg body weight of males and 0.25-0.80 ml ovaprim/kg body weight of females. Female catla is found to respond positively for a dose range of between 0.4-0.5 ml/kg, while rohu and mrigal respond to lower doses of 0.35 ml/kg and 0.25 ml/kg respectively. Among exotic carps, silver carp and grass carp are bred at doses ranging between 0.40-0.60 ml/kg. Big head carp bred successfully at 0.50 ml/ kg. For males of Indian carps, 0.10-0.15 ml/kg and for exotic male carps 0.15-0.20 ml/kg of dosages are found to be optimum. The method of injection is the same as pituitary.
In many countries including our country, ovaprim is used on a large scale for induced breeding of all cultivable fishes successfully. En Inde, initial trials were conducted during 1988 in Karnataka, Andhra Pradesh and Tamil Nadu.
Ovaprim has unique advantages over pituitary hormone – ready to use liquid form in 10 ml vial, consistent potency and reliable results, long shelf life, and can be stored at room temperature, formulated to prevent over dosing, male and female can be injected only once simultaneously, reduces handling and post breeding mortality, repeated spawning possible later in the season and high percentage of eggs, fertilization and hatching.
Dans ré uce ré fr e edin g w je t h o vati ré e
Ovatide is an indigenous, cost-effective and new hormonal formulation for induced breeding of fishes. The new formulation is having the base of a synthetic peptide which is structurally related to the naturally occuring hormone, goanadotropin releasing hormone (GnRH). GnRH is not a steroidal hormone and belongs to the class of organic substances called peptides. It is presented as a low viscosity injectable solution which is not only highly active but also cost-effective compared to other commercially available spawning agents. It is also effective in breeding major carps and catfishes. The doses for females are 0.20-0.40 ml/kg for rohu and mrigal, 0.40-0.50 ml/kg for catla, silver carp and grass carp and 0.20-0.30 ml/kg for calbasu. The dosages for males are 0.10-0.20 ml/kg for rohu, mrigal and calbasu, 0.20-0.30 ml/ kg for catla and 0.20-0.25 ml/kg for silver carp and grass carp.
The advantages of ovatide are:It is cost-effective hormonal preparation, it gives high fertilisation and hatching percentage (85-95%), it is increases egg production through complete spawning, it produces healthy seed, it is easy to inject due to its low viscosity, it does not cause adverse effects on brood fish after injection, it can be administered in a single dose to brooders, it can be stored at room temperature, it is quite effective even under climatic adversities and ovatide is available in the market as 10 ml vial, which costs Rs. 300. It is cheaper than ovaprim. The selection of brooders and injecting methods are similar to pituitary extract.
Indiana vous ce ré B reedin g esprit h Ovop e je
Ovopel, developed by the University of Godollo in Hungary, is a preparation containing mammalian GnRH and the water-soluble dopamine receptor antagonist, metoclopramide. The concentration of D-Ala6, Pro9NEt-mGnRH and metoclopramide are in the form of 18-20 micro gm/pellets and 8-10mg/pellets respectively. The hormone is thus available in pellet form. Each pellet contains superactive gonadoptropin releasing hypothalamic hormone analogue with an equal effect which a 3 mg normal acetone-dried dehydrated carp hypophysis gland has. Induced propagation of fish had been shown to be more effective if the hormone was administered in two doses, prime dose and resolving dose, as reported by Szabo, T., 1996. For cyprinids successful results were reported when 2-2.5 pellets/kg were administered to female brood fish. Cependant, preliminary trial with single injection of Ovopel gave encouraging result on a few species of Indian major carps and Clarias batrachus.
The required amount of ovopel was calculated on the basis of weight and condition of brood fish. The pellets were pulverized in a mortar and dissolved in distilled water. The trails were conducted in July-August of 1999.
The new inducing agent. ovopel is easy to store, simple to use and less expensive, as reported by Szabo. T, 1996. However, en Inde, detailed studies to establish its efficacy and economic viability are required to be undertaken. The hormone has been successfully tested for ovulation in several species of cyprinids, the Common carp, the Silver carp and the tench (Horvath et al, 1997) in Europe. Ovulation was also reported in African Cat fish (Brzuska, E. 1998). En Inde, Ovopel was used with success in induced breeding of major carps in UP, Haryana and Punjab. In Assam the trials conducted recently on Labeo rohita (Rohu), Cirrihinus mrigala (Mrigal), Labeo gonius (Gonius) and Clarias batrachus (Magur) gave encouraging results. This indicates the possibility of using this new hormone preparation for commercial production of fish seeds if made available to farmers at a competitive price.
ô t il r Di b personnel m ce s nous e ré F o r je m duc e ré B r ee ré dans g
Other substances like LH-RH analogues, steroids, and clomiphene are used for induced breeding of fishes.
LH-R H analo g euh :
Various analogues of Luteinizing hormone -releasing hormone (LH-RH) have been used for induced breeding of fishes. Investigations have revealed that the potential action of releasing hormone when dopamine antagonist is simultaneously used with the analogues is (10-100 µg/kg) used successfully in China. An analogue of teleost GNRH is found to be more potent than LH-RH. GNRH (Gonadotropin releasing hormone) stimulates GTH(Gonadotropin hormone) in teleosts (dosage 25-100 µg/kg).
S t e roids:
Selected steroid hormones are used to induce fish. The effects of steroid hormones on ovulation are seen primarily as germinal vesicle breakdown (GVBD). Ovulated oocytes require at least 4 hours to become fertilisable in mullets, whereas in most of the fishes oocytes are fertilisable immediately. The action of pituitary gonadotropins on oocyte maturation is known to be mediated through steroid hormones. Deoxycorticosterone acetate (DOCA) and cortisone effectively stimulate (dosage 50 mg/kg of fish) ovulation in Heteropneustes fossilis (Goswamy and Sunderraj, 1971). 17á-hydroxy-20B dihydroprogesterone (17á-20BDP) is useful to induce gold fish, trout and pikes (Jalabert, 1973). Other steroid hormones commonly used for spawning teleosts are cortisone acetate, deoxycortisol, deoxycorticosterone, hydroxycortisone, progesterone, 11 deoxycorticosterone and 20B progesteron. The advantages of steroids are:most compounds are available as pure preparations in synthetic forms, the quality of steroid preparations is uniform and steroid hormones are much cheaper than gonadotropin preparations.
Cl o miph e ne :
It is an analogue of the synthetic non-steroidal estrogen chlorotrianisene. It is known to have antiestrogenic effects in teleosts. It triggers the release of gonadotropins. The injections of clomiphene (10 µg/g) induced ovulation within 4 days in gold fish, whereas with same dosage, common carp spawned successfully after 40-64 hours.
E s t je m une t je o m o F E g g s :
The eggs are collected from the hapa by means of cup or tray or beaker and transferred to the buckets. The breeders are also removed from the hapa and their weights areoted. The difference in weights reveals approximately the number of eggs laid. The eggs are kept in a rectangular piece of close meshed mosquito net and allow the water to drain off. The eggs are measured in a beaker, mug or cup of known volume and transferred to hatcheries. Thus estimation of total quantity is made from total volume of the eggs measured. Percentage of fertilization can be arrived at by counting the number of fertilized eggs from egg samples of 1 ml measure.
B r la tête je m g o F C o m mois m c ar p :
Common carp (Cyprinus carpio) generally breeds in confined water. Spawning takes place in shallow marginal, weed infected areas from January to March and from July to August. Common Carp is also observed to breed round the year. Controlled breeding of common carp is conducted to achieve better spawning and hatching. A set of selected brooders one female and two males are put together in breeding hapa. In order to ensure successful spawning sometimes the female fish is injected with pituitary gland extract at a low dose 2 to 3 mg per kg. Body weight. Freshly washed aquatic weeds (Hydrilla, Najas, Eichhornia etc) are uniformly distributed inside the hapa. These aquatic weeds act as egg collections. The quantity of weed used is roughly double the weight of the female introduced. Each weed attached with 40, 000 to 1, 00, 000 eggs are distributed into a single hatching hapa. After 4 or 5 days the weeds are taken out carefully.












